Kimyasal Türler ve Etkileşimleri 9. Sınıf Konu Anlatımı
Doğada bulunan bütün maddeler tanecikli yapıdadır. Maddenin özelliğini gösteren en
küçük yapıtaşları olan taneciklere kimyasal tür denir.
Atomlar, moleküller, iyonlar ve radikaller kimyasal türleri oluşturur. Bu türler birbirini oluşturacağı gibi, bu türler arasında etkileşimlerde bulunmaktadır.
KİMYASAL TÜRLER ARASI ETKİLEŞİMLER
Zayıf ve güçlü etkileşimler olmak üzere iki türdür. Zayıf etkileşimler fiziksel özelliklerin, güçlü etkileşimler ise kimyasal özellikleri belirler.
Moleküller, atomlar, iyonlar ve radikaller kimyasal türleri meydana getirirler bu tanecikler etkileşerek yeni maddeleri oluşturur veya maddenin fiziksel hallerini belirler.
ATOMLAR: Bir maddenin bütün özelliklerini gösteren en küçük yapı taşlarıdır. Soygaz grubundaki elementler doğada atomik halde bulunurlar.
MOLEKÜLLER: En az iki atomun kimyasal bağ ile bağlanmasıyla oluşan maddelere denir. Moleküller aynı cins atomlardan veya farklı cins atomlardan da oluşabilir. Ametallar doğada moleküler halde bulunurlar.
Atomik Moleküller; O2, N2, F2 , Cl2 , P4, S8, O3 … gibi.
Bileşik Moleküller: CO2, NO2, SO2, HCl…gibi.
NOT: NaCl, AlCl3, NaNO3 gibi iyonik bileşikler esasen molekül değil iyonik kristaller olarak bilinirler. Kovalent bağlı bileşiklere molekül denir.
İYONLAR: Negatif veya pozitif yüklü olan bir atom veya atomlar grubuna iyon denir. Tuzlar iyonik bileşiklerdir.
Tek atomlu iyonlar ; N-3 ,S-2 ,F-1…
Çok atomlu iyonlar ; OH-,NH4+, CO3-2…
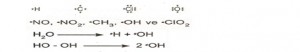
RADİKALLER: Oktetini tamamlamamış bir ya da daha fazla ortaklaşmamış elektronu bulunan kimyasal türlere radikaller denir. Radikaller yüksek enerjili ve kararsız ara ürünlerdir. Ortaklaşmamış elektronlar tek bir noktayla gösterilir.
Örnek:
I – .CH3
II- Na+
III – N2
IV –
Verilen maddelerden hangileri radikal gruptur?
Çözüm: Atom veya atom grupları bir veya birden fazla eşleşmemiş elektron bulunduruyorsa radikal denir.
Cevap:I ve IV
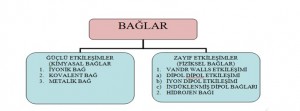
GÜÇLÜ ETKİLEŞİMLER
Atomları bir arada tutan çekim kuvvetine kimyasal bağ denir. Bağ oluşumları ekzotermik ( ısı veren ) bağ kopmaları endotermiktir ( ısı alan ).
Kimyasal bağ üç türdür:
1. iyonik bağ
2. kovelent bağ
3. metalik bağ
İYONİK BAĞ: Metal ve ametal atomların elektron alışverişiyle oluşturduğu bağa iyonik bağ denir. Yani zıt yüklü katyon ve anyoların arasındaki çekim kuvvetleridir.
KOVALENT BAĞLAR VE ORBİTAL ÖRTÜŞMELERİ
Ametal atomlarının elektron ortaklaşması sonucu oluşturduğu bağa kovalent bağ denir. Kovalent bağ oluşurken en az iki elektron ortaklaşa kullanılır ve kullanılan bu elektronlar zıt sipinlidir. Ortaklaşa kullanılan elektron çifti tek çizgiyle ( – ) gösterilir.
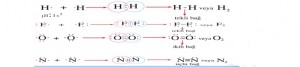
H2 molekülü oluşurken her bir hidrojen elektronu birbirini iter. Fakat bu elektronlar itme kuvvetini yenecek şekilde hızlanarak çarpışırlar. Yani yarı dolu s orbitalleri örtüşür. Çekirdekler arasındaki elektronlar bir çekim kuvveti oluşturur ve bu olaya orbital örtüşmesi denir.
Kovalent bağlar orbitallarin örtüşmesiyle oluşur. Örneğin HCl bileşiği oluşurken s ve p orbitalleri örtüşür, F2 molekülleri oluşurken de s-s orbitalleri örtüşür.
A ) Apolar kovalent bağ : Aynı ametal atomlarının elektron ortaklaşması yaparak oluşturduğu bağa denir. Ortaklaşa kullanılan elektronlar her iki atom tarafından eşit oranda çekilir ve bir kutuplaşma meydana gelmez. H2, N2, O2, Cl2 ve O3 moleküllerinde apoler kovalent bağ bulunur. Atomlar arasındaki tekli bağlar sigma bağıdır. Sigma bağları oluşmadan pi bağları oluşmaz. Sigma bağları pi bağlarından kuvvetlidir. Kimyasal tepkimelerde önce pi bağları kopar. Açık zincirli moleküllerde sigma bağ sayısı atom sayısından 1 eksiktir. Siklo ( halkalı ) bileşiklerde ise atom sayısına eşittir.
B ) Polar kovalent bağ : Farklı ametal atomlarının elektron ortaklaşması yaparak oluşturduğu bağa denir. Ortaklaşa kullanılan elektronlar her bir atom tarafından farklı bir kuvvetle çekildğinden kutuplaşma meydana gelir. CO2, HCl, H2O, NH3, BF3 ve CH4 gibi moleküllerde polar kovalent bağ oluşturur.
C) Koordine kovalent bağ:
Kovalent bağ iki elektronun ortaklaşa kullanılmasıyla oluşur. Ortaklaşa kullanılan elektronların her ikisini de aynı atom veriyorsa oluşan bağa koordine kovalent bağ denir
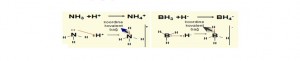
N ve H arasında ortak kullanılan elektronların her ikisine de N atomu vermiştir.
NH4+ , BF4- , SO2, H3O+ taneciklerinde koordine kovalent bağ bulunur.
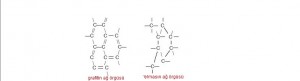
Kovalent ağ örgüsü:
Grafit,elmas ve katı silisyumda ağ örgülü kovalent yapı vardır. Kovalent ağ örgüsü bulunan katıları erime noktaları yüksektir. .Elmasta her karbon atomuna 4 karbon atomu bağlıdır. Grafitde ise karbon atomları altıgen halkalar şeklinde bulunur.
MOLEKÜLLERDE POLARLIK VE APOLARLIK
Merkez atomun çevresindeki atomların çekim kuvvetleri birbirini nötürlüyorsa
( dipolmoment=0) molekül apolar,
şayet çekim kuvvetleri nötürlemiyorsa ve bir kutuplaşma oluyorsa ( dipolmoment ≠ 0) molekül polardır.
Örneğin: CH4, BF3, CO2,N2,H2 apolar ; NH3,H2O,CH3Cl,HF,HBr..polar moleküllerdir.
METALİK BAĞ
Metal atomların kendi aralarında elektron alışverişi veya ortaklaşması yaparak bağ oluşturamazlar. Metaller son yörüngedeki değerlik elektronlarına fazla bir çekim kuvveti uygulayamaz. Metaller bu elektronları vererek soygaz elektron düzeyine ulaşmaya çalışırlar. Metallerin son yörüngelerindeki orbitallerin çoğunluğu boştur, bu da elektronların rahat bir şekilde hareket etmesini sağlar.
Birden fazla metal atomu bir arada bulunduğunda komşu atomların değerlik elektronları karşılıklı eş enerjili orbitallere geçiş yapmaya başlar. Böylece hareketli elektronlar bir elektron denizi oluşturur. Oluşan bu elektron denizi metallerin bir arada tutulmasını sağlar. Bu elektron denizi ile pozitif metal iyonlar arasındaki elektriksel çekime metalik bağ denir. Metallerde değerlik elekton sayısı arttıkça metalik bağ kuvveti artar.
ZAYIF ETKİLEŞİMLER
Molekülle arası etkileşimlere zayıf etkileşimler denir. Zayıf etkileşimler maddenin katı, sıvı ve gaz halinde olmasını belirler.
1. Van der Waals bağları 2. Hidrojen bağı
a. Dipol-dipol bağları
b. İyon-dipol bağları
c. İndüklenmiş dipol bağları
KALICI VE GEÇİCİ ( İNDÜKLENMİŞ ) DİPOLLER
Polar moleküllerde kalıcı dipoller olşur. Örneğin ; HCl, HBr, NH3 ve H2O da kalıcı dipoller oluşur. Apolar moleküllerde ( N2, O2, CH4, BF3 ) geçici dipoller oluşur.
Apolar moleküllerde ve soygaz atomlarında elektron yoğunluğu eşit olarak dağılmıştır. Bundan dolayı kalıcı dipoller oluşmaz. Bu tür maddelere dışarıdan elektriksel etki yapıldığında elektronlar atomun veya molekülün bir bölgesinde toplanır. Bu sayede apolar moleküller veya soygazlar polar yapı kazanır. Bu şekilde oluşan dipollere indüklenmiş ( geçici dipol ) denir.
1. VANDER WAALS ETKİLEŞİMİ :
Polar veya apolar moleküllerin hem kendi aralarında hemde başka taneciklerle yapmış olduğu fiziksel bağlar(hidrojen bağı hariç) vander waals bağı olarak adlandırılır. Bu bağlar maddenin yoğun fazında (katı ve sıvı) etkilidir.
A) DİPOL DİPOL ETKİLEŞİMİ
Polar moleküller arasında oluşan etkileşimlere denir. Bir molekülün artı(+) kutbu ile diğer molekülün eksi (–) kutbu arasında gerçekleşen çekim kuvvetleridir. H2S ,HCl ve HBr..vb bileşiklerde dipol dipol etkileşimi etkindir.Dipol dipol bağlarında hem çekme hemde itme kuvvetleri bulunur.
B) İYON- DİPOL BAĞLARI
Kalıcı dipollerin pozitif kutbu ile negatif iyonlar ve kalıcı dipolün negatif kutbu ile pozitif iyonlar arasında bir elektriksel çekim kuvveti oluşur. Bu çekim kuvvetine iyon-dipol bağları denir.
İyonik katıların ( NaCl, KF, CaBr2… ), su gibi polar çözücülerde çözündüğünde iyon – kalıcı dipol etkileşimleri oluşur
C) İNDÜKLENMİŞ DİPOLLER ARASINDAKİ BAĞLAR
Apolar moleküllerin ve soygazların uygun koşullar sağlandığında sıvı veya katı hale geçe bildiği görülmüştür. Buda apolar moleküller ve soygaz atomları arasında bir etkileşim oluştuğunu gösterir.Apolar moleküllerde ve soygazlarda anlık geçici dipoller oluşur. Farklı atom veya moleküllerin anlık kısmi yükleri birbirini çeker ve böylece moleküller arası bağlar oluşur. Oluşan bu etkileşime indüklenmiş dipol-indiklenmiş dipol etkileşimi denir. İndüklenmiş dipoller arasındaki çekim kuvveti ilk kez FRİTT London tarafından açıklandığı için bu kuvvetlere London kuvvetleri de denir. Londan kuvvetleri moleküller arası etkileşimin en zayıfıdır.
İyon-indüklenmiş dipol etkileşimi:
Geçici indüklenmiş moleküller (apolar molekül) ile iyonik bir maddenin iyonları arasında oluşan anlık çekim kuvvetlerine denir. Bu etkileşim çok zayıftır ve iyonları birbirinden ayırarak çözmeye yeterli değildir. Örneğin apolar olan CH4 molekülü ile iyonik yapılı NaCl karıştırıldığında anlık çok zayıf iyon-indüklenmiş dipol bağları oluşur . fakat bu bağlar Na+ ve Cl- arasındaki kuvvetli iyonik bağları koparamadığından çözünme gerçekleşmez.
Dipol- indüklenmiş dipol etkileşimi :
Polar moleküller ile indüklenmiş dipoller rasında oluşan anlık çekim kuvvetleri dipol- indüklenmiş dipol bağlarıdır..dipol- indüklenmiş dipol bağları, polar moleküller arasındaki ğüçlü dipol –dipol bağlarını koparmaya yetmediğinden çözünme olmaz.
Örneğin, polar H2O ve apolar CH4 molekülleri birbiri içinde çözünmez.